Протеасома является основным протеолитическим аппаратом, который регулирует клеточный протеостаз путем избирательной деградации убиквитилированных белков. Поскольку поддержание белкового гомеостаза имеет важное значение для здоровья человека, неисправности убиквитин-протеасомной системы (UPS) вызывают различные заболевания, такие как рак, воспаление и нейродегенерация. Однако мы еще не знаем общих принципов, лежащих в основе UPS. В этом исследовании исследовательская группа обнаружила новый способ расщепления белка ИБП в условиях стресса.
“Около 2013, мы обнаружили, что протеасомы образуют ядерные очаги в ответ на гиперосмотические раздражители. Это было очень впечатляюще, потому что равномерно распределенные протеасомы образуют очаги всего за несколько секунд, но потребовалось время, чтобы понять, что означает это явление, пока мы знаем разделение жидкой фазы (LLPS). LLPS является быстрым, обратимым и широко распространенным механизмом компартментализации в клетках. Фокусы протеасом действительно проявляют поведение, подобное жидкости, и серия экспериментов показала, что LLPS протеасом предназначен для деградации убиквитилированные белки», – сказал Ясуши Саэки, доктор философии, ведущий автор исследования. Результаты исследования были опубликованы в Nature 5 февраля 2020.
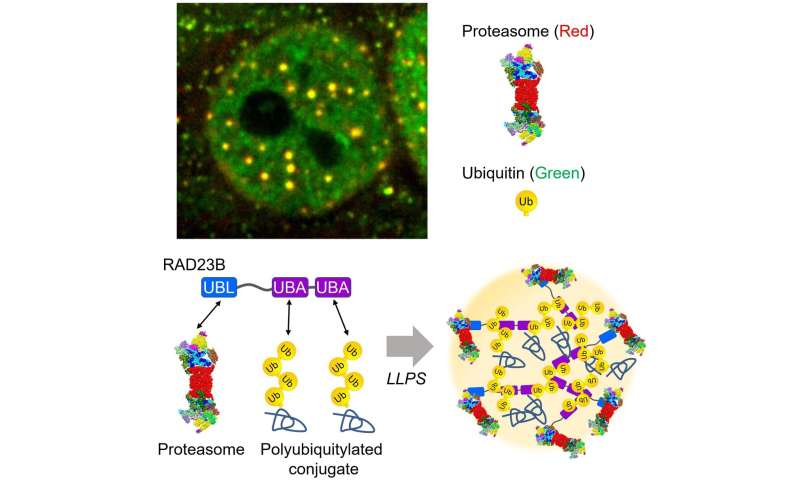
Капли протеасом, вызванные гиперосмотическим стрессом, представляют собой временную структуру, которая исчезает через несколько часов после обработки сахарозой. Протеасомные капли также содержат убиквитилированные субстраты и множество протеасом-взаимодействующих белков. Образование капелек протеасомы зависит от убиквитилирования белка, а их исчезновение зависит от активности протеасомы, что указывает на то, что капли способствуют деградации белка. Острый гиперосмотический стресс вызывает уменьшение объема клеток и ядрышкового стресса, что приводит к нарушению биосинтеза рибосом, а также к накоплению бесхозных рибосомных белков в качестве основного субстрата UPS в нуклеоплазме. Действительно, гиперосмотический стресс вызывает убиквитилирование рибосомальных белков и их деградацию в каплях протеасом. Таким образом, повышенный уровень убиквитилированных белков вызывает образование капель протеасомы.
Dr. Saeki и его коллеги дополнительно исследовали, как протеасомы рекрутируются в этот флюидный отдел. Исследовательская группа определила RAD 23 B, фактор трансформации субстрата протеасомы, в качестве ключевой молекулы, которая индуцирует LLPS убиквитилированных клиентов, а также протеасомы. RAD 23 B имеет два типичных убиквитин-связывающих домена (UBA) и один протеасом-связывающий домен (UBL). Группа успешно воссоздала R- 23 B- и убиквитинсодержащие капли in vitro и показала, что слабые многовалентные взаимодействия между Домены UBA RAD 23 B и длинные полимерные цепи убиквитина приводят к разделению фаз. Взятые вместе, RAD 23 B собирает клеточные убиквитилированные белки через домены UBA с образованием капель, а затем рекрутирует протеасомы через домен UBL.
“Это исследование является хорошим примером взаимодействия между передачей сигналов убиквитина и LLPS. Учитывая, что убиквитин в основном функционирует как полимер, одним из биологических значений полимеризации может быть LLPS. Будет очень интересно выяснить, подвергаются ли другие убиквитин-связывающие белки фазовому разделению», – сказал доктор Саеки. «Кроме того, было высказано предположение, что склонные к агрегации белки превращаются из жидких капель в твердые подобные сборки. В этом контексте острый гиперосмотический стресс может привести к необратимому накоплению белковых агрегатов, особенно когда активность протеасом снижается».